ビフィズス菌は小腸下部〜大腸に棲息しており、私達ヒトが消化・吸収できない複雑な糖質を分解できるユニークな酵素を多数持っています。農研機構・食総研のグループによってビフィズス菌から発見されたN-アセチルヘキソサミン1-キナーゼ(NahK)と呼ばれる酵素は、ヒトの母乳に含まれる複雑なオリゴ糖を分解する代謝系で重要な役割を担います。また、いくつかの糖から糖-1リン酸を作る機能を持つため、有用オリゴ糖合成への応用が期待されている酵素です。

MPEG movie (1.1 MB)はこちら
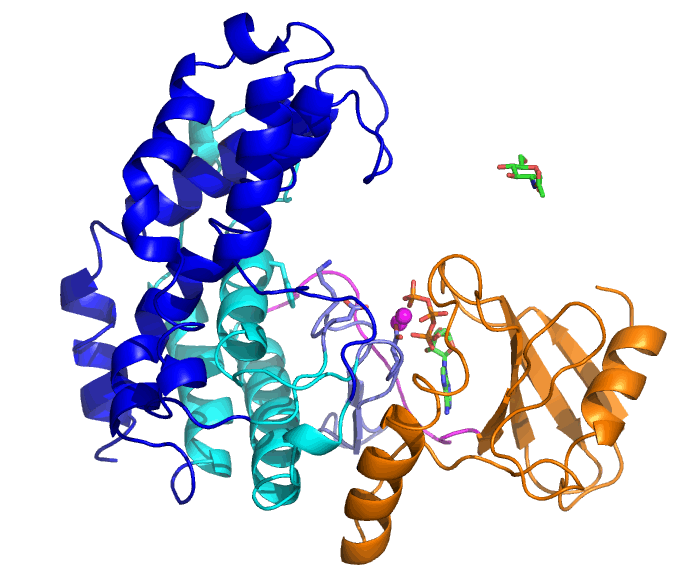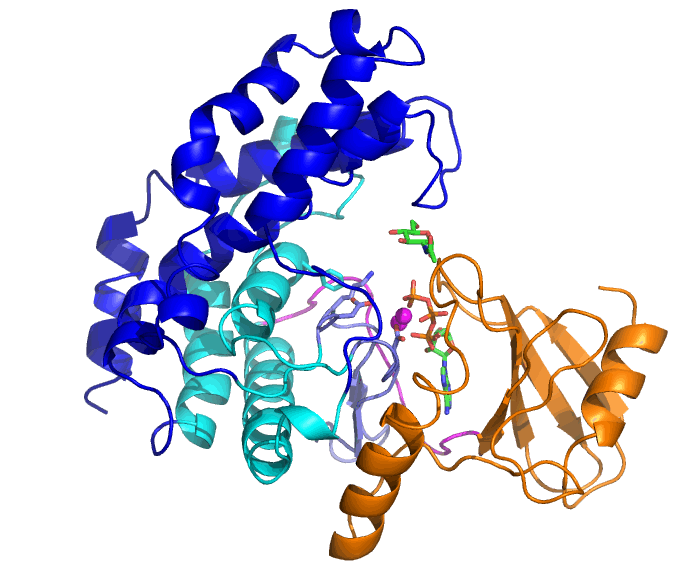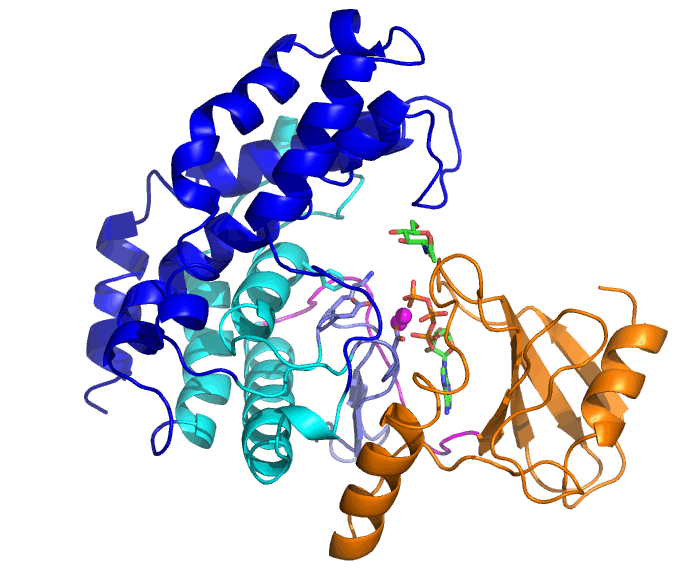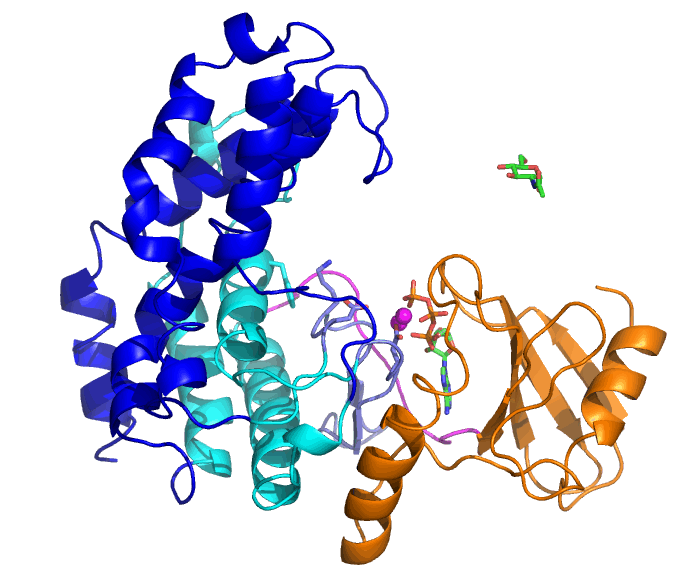
NahKの基質はATP、2つのMg2+と糖(この場合はN-アセチルグルコサミン(GlcNAc))ですが、ATPとMg2+が結合した「開いた」状態から、GlcNAcの結合により「閉じた」状態へと変化します。ATPの結合しているN末端ドメイン(橙色)に対して、C末端側のヘリックスからなるドメイン(青と水色)が大きく動いていることが分かります。
本研究の詳細に関しては以下の論文をご覧ください。
M. Sato et al.
Open–close structural change upon ligand binding and two magnesium ions required for the catalysis of N-acetylhexosamine 1-kinase
BBA - Proteins Proteom. 1854 (5), 333–340 (2015)
M. Sato, T. Arakawa and S. Fushinobu